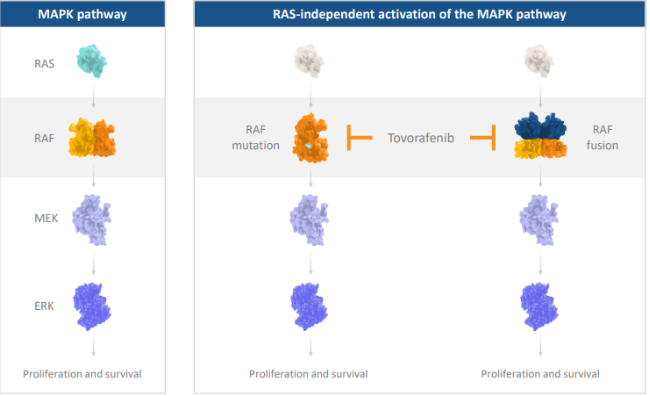
2024年4月23日,FDA加速批准Day One Biopharmaceuticals开发的泛RAF激酶抑制剂Ojemda(tovorafenib)上市,用于治疗6个月及以上的复发或难治性儿童低级别胶质瘤(pLGG)患者,这些患者存在BRAF融合或重排,或BRAF V600突变。Ojemda是用于治疗该疾病的全身疗法,它能够抑制携带BRAF融合或BRAF V600突变的肿瘤的生长,并且具有大脑渗透性。先前被FDA授予突破性疗法和罕见儿科疾病资格,这也是基于FIREFLY-1临床2期试验数据获批的原因之一。
儿科低级别胶质瘤是儿童中最常见的脑瘤,在美国,儿童LGG年发病率为每十万人1.3~2.1例,预计每年有1000-1600例新发病例。2023年3月16日,FDA批准了诺华的BRAF/MEK组合即Tafinlar(dabrafenib,达拉非尼)联合Mekinist(trametinib,曲美替尼),这是pLGG的首个靶向疗法。